Эпидемиология и биология нейроэндокринных опухолей
Термин «нейроэндокринные опухоли» объединяет гетерогенную группу совершенно разных новообразований, происходящих из клеток с одноименным названием. Нейроэндокринные клетки могут выделять те же вещества, что и нейроны, но, в отличие от последних, они участвуют не в топической, а в паракринной регуляции органов и тканей.
Термин «нейроэндокринные опухоли» объединяет гетерогенную группу совершенно разных новообразований, происходящих из клеток с одноименным названием. Само понятие «нейроэндокринная клетка» неоднократно подвергалось переоценке. В частности, в 1969 г. A. Pearse предложил использовать аббревиатуру APUD (amino precursor uptake and decarboxylation) для клеток, способных продуцировать нейрон-специфические полипептидные гормоны и биогенные амины [11]. Таким образом, нейроэндокринные клетки могут выделять те же вещества, что и нейроны, но, в отличие от последних, они участвуют не в топической, а в паракринной регуляции органов и тканей. Они разбросаны по всему организму и являются важнейшим компонентом поддержания гомеостаза. Нейроэндокринной обычно считается клетка, обладающая следующими характеристиками:
1) продукция нейротрансмиттеров, нейромодуляторов или нейропептидных гормонов;
2) наличие специфических секреторных гранул, которые высвобождают биологически активные вещества в ответ на действия каких-либо сигналов;
3) отсутствие аксонов и синапсов.
Развитие новых лабораторных технологий значительно упростило идентификацию нейроэндокринных клеток. Одним из наиболее характерных маркеров нейроэндокринных компонентов является хромогранин А [7, 8, 15]. Другим универсальным антигеном опухолей данной группы является рецептор CD56; последнее свойство легло в основу разработки таргетного иммуноконъюгата ВВ-10901, состоящего из CD56-специфического гуманизированного антитела huN901 и клеточного токсина DM1 [9].
В зависимости от контекста, к нейроэндокринным опухолям относят совершенно разные группы новообразований. При наиболее узкой трактовке этого термина в основном упоминаются карциноиды и нейроэндокринные опухоли желудочнокишечного тракта. Эта же категория неоплазий может включать новообразования эндокринных клеток желёз внутренней секреции, в частности медуллярный рак щитовидной железы, феохромоцитому, опухоли гипофиза. К нейроэндокринным опухолям также относят так называемую карциному Меркеля, происходящую из тех клеток кожи, которые обеспечивают тактильную чувствительность. Все перечисленные выше неоплазмы исключительно редки, в отличие от ещё одной опухоли с нейроэндокринными свойствами - мелкоклеточного рака лёгкого (МКРЛ). Однако предположение о нейроэндокринном происхождении МКРЛ последнее время стало подвергаться ожесточённой критике [1, 5, 8, 10].
Основные разновидности нейроэндокринных опухолей
Карциноиды представляют наиболее частую группу нейроэндокринных новообразований. Их встречаемость составляет 1-2 случая на 100 000 человек. Они развиваются из так называемых клеток Кульчицкого. Характерной особенностью карциноидов является продукция серотонина. При высоком уровне серотонина у пациентов наблюдается так называемых карциноидный синдром, характеризующийся повышением артериального давления, диареей, сердечными расстройствами и т.д. Наиболее часто карциноиды обнаруживаются в лёгких, тонкой кишке и прямой кишке. Встречаемость карциноидов в других органах, в частности в толстой кишке, желудке, аппендиксе, яичниках и т.д. заметно ниже [1, 6].
Сходную с карциноидами частоту обнаруживают нейроэндокринные опухоли гастропанкреатодуоденальной зоны [2]. Большинство из них располагается непосредственно в поджелудочной железе, в незначительном проценте случаев объектом поражения выступает двенадцатиперстная кишка. Примечательно, что нейроэндокринные новообразования поджелудочной железы зачастую характеризуются довольно вялым течением и поэтому не диагностируются. Результаты аутопсий свидетельствуют, что число носителей индолентных нейроэндокринных опухолей поджелудочной железы может достигать 10%. Нейроэндокринные панкреатокарциномы принято подразделять на функционирующие и нефункционирующие. Функционирующие опухоли секретируют биологически активные вещества, что значительно облегчает их диагностику. Наиболее характерной опухолью этого класса является инсулинома, составляющая до 70-75% нейроэндокринных опухолей поджелудочной железы. 20-25% карцином могут представлять гастриномы. Остальные разновидности (VIP-омы, глюкагономы, соматостатиномы и т.д.) встречаются достаточно редко. Секреция того или иного гормона не является стабильным параметром опухоли: многие неоплазмы могут секретировать несколько биологически активных веществ, причём, по мере прогрессирования опухоли спектр продуцируемых молекул зачастую подвергается изменениям. Нефункционирующие неоплазмы могут обнаруживаться на более поздних стадиях, чем функционирующие и характеризуются относительно агрессивным течением [1, 6, 7, 12].
Молекулярная генетика спорадических и наследственных нейроэндокринных опухолей
Патогенез нейроэндокринных опухолей, как и других карцином, сопряжён с накоплением соматических мутаций в онкогенах и антионкогенах. Многие характерные для карцином нарушения, в частности делеции участков хромосом («потери гетерозиготности»), метилирование регуляторных областей генома, аномалии экспрессии генов, обнаруживаются и в новообразованиях нейроэндокринного происхождения, однако, в последнем случае подавляющая часть известных на сегодняшний день геномных дефектов не проявляет какой-либо специфичности [8].
Наиболее заметными являются успехи в области идентификации генетических детерминант множественных эндокринных неоплазий наследственного характера. Примечательно, что гены, зародышевые мутации в которых были выявлены при изучении семейных раков, играют ключевую роль и в патогенезе спорадических опухолей; в последнем случае мутация носит не наследственный, а спорадический характер [8].
Носительство герминальной мутации является единственным известным фактором, увеличивающим риск нейроэндокринного новообразования. Внешние факторы, такие как алкоголь, курение, производственные вредности, не влияют на развитие новообразований данной группы, за исключением мелкоклеточного рака лёгкого [1].
Наибольшую известность получили мутации гена MEN-I, лежащие в основе синдрома множественных эндокринных неоплазий I типа (MEN-I). Данный синдром характеризуется развитием аденом щитовидной железы, нейроэндокринных карцином гастропанкреатодуоденальной зоны, а также опухолей гипофиза. В случае обнаружения мутации индивидуальный риск поражения паращитовидных желёз составляет около 90%, т.е. в данном случае наблюдается исключительно высокая пенетрантность мутантного гена. Сходная пенетрантность наблюдается для коллагеном и ангиофибром лица. Другие опухоли, например гастриномы, инсулиномы, пролактиномы, наблюдаются менее чем у половины носителей дефектов гена MEN-I [1].
Ген MEN-I кодирует белок, участвующий в регуляции целостности клеточного генома. Помимо этого, он осуществляет координацию транскрипции ряда генов. Следует ещё раз подчеркнуть, что мутации в гене MEN-I выявляются не только в семейных случаях неоплазий, но и в качестве соматического события в спорадических нейроэндокринных опухолях. Идентификация носителей MEN-I необходима исключительно для организации мер по ранней диагностике новообразований; профилактические операции при синдроме множественных эндокринных неоплазий первого типа не проводятся [8].
Причиной синдрома множественных эндокринных неоплазий II типа (MEN-II), как правило, является активация гена RET. Необходимо заострить внимание на необычности подобной ситуации: как правило, в основе патогенеза наследственных опухолевых синдромов лежит не стимуляция функции онкогена, как в данном случае, а инактивирующее событие, мишенью которого является ген-супрессор. Наиболее характерная черта синдрома MEN-II - частая встречаемость медуллярных карцином щитовидной железы. Так как пенетрантность мутаций RET по отношению к щитовидной железе достигает почти 100%, у носителей дефектного варианта этого гена практикуется профилактическая тиреоидэктомия в раннем детском возрасте. Другой характерной опухолью для RET является феохромоцитома [3]. Помимо гена RET, синдром множественных эндокринных неоплазий II типа может инициироваться мутациями в генах VHL, SDHD и SDHB [1].
Мелкоклеточный рак лёгкого - наиболее агрессивная форма бронхолегочных карцином, составляющая примерно 20% от онкологических заболеваний этого органа. МКРЛ характеризуется исключительно злокачественным течением. Менее 5% пациентов с МКРЛ диагностируются на ещё операбельной стадии заболевания. Мелкоклеточный рак лёгкого характеризуется относительной химиочувствительностью, однако, вскоре после ответа на назначение цитостатиков обычно развивается фатальный рецидив [14].
Мелкоклеточный рак лёгкого зачастую противопоставлялся немелкоклеточным гистологическим типам этого заболевания. Помимо агрессивного течения и химиочувствительности, для МКРЛ характерны многие черты нейроэндокринных опухолей, в частности своеобразная форма клеток, напоминающая элементы APUD-системы, а также способность секретировать некоторые биологически активные вещества. В последнее время гипотеза о нейроэндокринном происхождении МКРЛ утратила свою популярность. Многие специалисты считают, что нейроэндокринные черты МКРЛ являются не сохранёнными признаками исходных нормальных клеток, а, напротив, представляют из себя особенности, приобретённые в ходе опухолевой прогрессии. Весьма вероятно, что в основе всех гистологических типов рака лёгкого (РЛ) лежит единый предшественник, так называемая плюрипотентная стволовая клетка эпителия дыхательных путей. Подобная гипотеза вызывают симпатию многих специалистов, так как действительно, мелкоклеточные и немелкоклеточные формы лёгочных карцином демонстрируют намного больше сходства, чем различий [4, 5, 10].
В частности, эпидемиология МКРЛ не отличается от таковой при других гистологических разновидностях РЛ (рис. 1). Основным этиологическим фактором заболевания является курение. По-видимому, существенный вклад в формирование онкологического риска вносит также наследственность [4].
Для опухолей лёгкого характерна аутокринная активация множественных сигнальных каскадов (рис. 2). В частности, в большинстве РЛ наблюдается избыточность сигналов, посылаемых рецепторными тирозинкиназами. Например, во многих МКРЛ отмечается повышение экспрессии онкогена KIT. При этом KIT сохраняет интактную структуру белка, что объясняет неудачи попыток лечения МКРЛ при помощи препарата гливек. Другой характерной особенностью МКРЛ является аутоактивация рецепторов, ассоциированных с G-белками. Данные рецепторы имеют весьма необычную структуру: они пересекают клеточную мембрану 7 раз за счёт наличия семи трансмембранных доменов. От мембранных рецепторов сигнал передаётся по так называемому RAS/RAF/mEk/ MAPK-каскаду. Примечательно, что активация упомянутого каскада может происходить и без вовлечения рецепторов, например вследствие мутации в генах семейства rAs. В случае мутации, белки RAS теряют способность гидролизовать связанный с ними ГТФ в ГДФ, что сопровождается утратой механизма негативной ауторегуляции. Практически во всех РЛ наблюдается инактивация супрессорных биохимических каскадов. В частности, нарушения в работе сигнальных путей, ассоциированных с белками RB1 и р53, приводят к безостановочному делению клетки вследствие потери контроля над клеточным циклом. В МКРЛ инактивация RB1 часто осуществляется непосредственно за счёт делеции гена, что отличает мелкоклеточные раки от немелкоклеточных; в последних утрата функции RB1-каскада достигается за счёт мутационных событий в белках-регуляторах ретинобластомного протеина [4, 9, 13].
Для мелкоклеточных опухолей лёгкого весьма характерна амплификация онкогенов семейства MYC, что сопровождается целым спектром биологических эффектов.
Рис. 1. Этиология опухолей лёгкого. Адаптировано из [4].
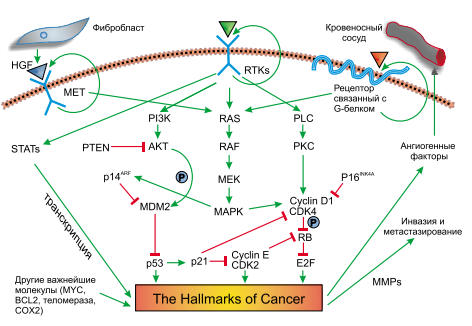
Рис. 2. Сигнальные каскады в опухолях лёгкого. Адаптировано из [4].
И, наконец, большой интерес вызвало обнаружение в опухолях у человека фермента, называемого теломеразой. Данная молекула отвечает за целостность терминальных последовательностей ДНК. Дело в том, что при каждом делении клетки концевые участки хромосом укорачиваются, что связано с физико-биохимическими особенностями механизмов репликации ДНК. Многие исследователи полагают, что укорочение ДНК лежит в основе так называемого лимита Хэйфлика, т.е. ограничения репликативного потенциала клеток. Примечательно, что те немногие клетки, которые обладают способностью к бесконечному делению, экспрессируют теломеразу. Теломераза обладает способностью восстанавливать утраченные при делении фрагменты ДНК, что обеспечивает бессмертие клеточного клона. Примечательно, что теломераза практически не выявляется в нормальных тканях, в то время как большинство новообразований, включая мелкоклеточные раки лёгкого, экспрессируют заметные количества этого фермента. Предполагается, что теломераза может оказаться удачной мишенью для противоопухолевой терапии [9, 13].
Работа выполнена при поддержке гранта Правительства Москвы (проект 15/05-Ген-М). Автор благодарит канд. биол. наук ЕШ. Кулигину за подготовку рисунков для публикации.
Литература
1. Barakat M.T, Meeran K., Bloom SR. Neuroendocrine tumours // Endocrin. Relat. Cancer. - 2004. - Vol. 11. - P. 1-18.
2 Gore RM, Berlin JW, Mehta U.K. et al. GI carcinoid tumours: appearance of the primary and detecting metastases // Best Pract. Res. Clin. Endocrinol. Metab. - 2005. - Vol. 19. - P. 245-263.
3. IchiharaM.,Murakumo Y, TakahashiM. RET and neuroendocrine tumors // Cancer Lett. - 2004. - Vol. 204. - P. 197-211.
4. Imyanitov EN, Kuligina ESh, Belogubova E.V. et al. Mechanisms of lung cancer // Drug. Discov. Today: Dis. Mech. - 2005. - Vol. 2. - P. 213-223.
5. Junker K., Wiethege T, Muller KM. Pathology of small-cell lung cancer // J. Cancer. Res. Clin. Oncol. - 2000. - Vol. 126. - P. 361-368.
6. Kaltsas G., Rockall A., Papadogias D. Et al. Recent advances in radiological and radionuclide imaging and therapy of neuroendocrine tumours // Europ. J. Endocrinol. - 2004. - Vol. 151. - P. 15-27.
7. Kulke MH. Neuroendocrine tumours: clinical presentation and management of localized disease // Cancer Treat. Rev. - 2003. - Vol. 29. - P. 363-370.
8. Leotlela PD, Jauch A., Holtgreve-Grez H., Thakker RV. Genetics of neuroendocrine and carcinoid tumours // Endocrin. Relat. Cancer. - 2003. - Vol. 10. - P. 437-450.
9. Murray N, Salgia R., Fossella F.V. Targeted molecules in small cell lung cancer // Semin. Oncol. - 2004. - Vol. 31 (Suppl. 1). - P. 106-111.
10. Otto W.R Lung epithelial stem cells // J. Pathol. - 2002. - Vol. 197. - P. 527-535.
11. Pearse AG. The cytochemistry and ultrastructure of polypeptide hormone-producing cells of the APUD series and the embryologic, physiologic and pathologic implications of the concept // J. Histochem. Cytochem. - 1969. - Vol. 17. - P. 303-313.
12. Rindi G, Bordi C. Highlights of the biology of endocrine tumours of the gut and pancreas // Endocrin. Relat. Cancer. - 2003. - Vol. 10. - P. 427-436.
13. SattlerM., Salgia R Molecular and cellular biology of small cell lung cancer // Semin. Oncol. - 2003. - Vol. 30. - P. 57-71.
14. Simon GR, WagnerH. American College of Chest Physicians. Small cell lung cancer // Chest. - 2003. - Vol. 123 (Suppl. 1). - P. 259-271.
15. Taupenot L, Harper K.L., O'Connor D.T. The chromogranin-secretogranin family // New Engl. J. Med. - 2003. - Vol. 348. - P. 1134-1149.
Поступила в редакцию 27.11.2005 г.

